リンチ症候群(LS)の遺伝学的検査
MMR遺伝子検査
リンチ症候群(LS)とは
リンチ症候群(Lynch syndrome:LS)は、生殖細胞系列におけるミスマッチ修復(Mismatch Repair:MMR)遺伝子であるMLH1,MSH2,MSH6,PMS2遺伝子とEPCAM遺伝子の病的バリアントを原因とする遺伝性疾患です。全大腸がんのうち、5~10%は遺伝性であると言われています。遺伝性大腸がんの中で最も頻度が高いのがLSです。LSでは大腸がんだけではなく子宮内膜がん(子宮体がん)や卵巣がんなど、リンチ症候群関連がん(LS関連がん)として知られている複数のがんの発症リスクも、一般集団と比較して高いことが知られています(表1)。そのため、がんが散発性なのかLSによるものかを明確にすることは、医学的管理を行う上で重要と考えられています。しかし、LSは臨床所見だけでは診断することができず、確定診断には遺伝学的検査が必要です。
LS関連がんとして、おもに大腸がん、子宮内膜がん、胃がん、卵巣がん、腎盂・尿管がんなどが知られています(表1)。また、リスク値は明らかではありませんが、乳がんの発症リスク上昇についても報告されています1)。
表1 LS関連がん発症リスク
| がん種 | 70歳までの累積発症リスク2) | 日本人の生涯発症リスク3) |
|---|---|---|
| 大腸がん | 男性 54-74% | 男性 10.2% |
| 女性 30-52% | 女性 8.0% | |
| 子宮内膜がん | 28-60% | 2.0% |
| 胃がん | 5.8-13% | 男性 10.3% |
| 女性 4.7% | ||
| 卵巣がん | 6.1-13.5% | 1.6% |
| 腎盂・尿管がん | 3.2-8.4% | - |
| 大腸がん | 70歳までの累積発症リスク2) 男性 54-74% 女性 30-52% |
日本人の生涯発症リスク3) 男性 10.2% 女性 8.0% |
|---|---|---|
| 子宮内膜がん | 70歳までの累積発症リスク2) 28-60% |
日本人の生涯発症リスク3) 2.0% |
| 胃がん | 70歳までの累積発症リスク2) 5.8-13% |
日本人の生涯発症リスク3) 男性 10.3% 女性 4.7% |
| 卵巣がん | 70歳までの累積発症リスク2) 6.1-13.5% |
日本人の生涯発症リスク3) 1.6% |
| 腎盂・尿管がん | 70歳までの累積発症リスク2) 3.2-8.4% |
日本人の生涯発症リスク3) - |
また、NCCNガイドラインでは、原因遺伝子別にLS関連がんの累積がん発症リスクが記載されています1)。
LSには臨床診断ができるほどの明確な臨床的特徴はありませんが、LSが疑われる特徴の1つに、がん組織で高頻度にマイクロサテライト不安定性(MSI-High)を示すということがあります。これはLSを診断するうえでも、とても重要な情報となります。
LSの診断
遺伝性大腸癌診療ガイドラインでは、LSが疑われる患者に対してスクリーニングを行い、LSの疑いが濃厚な患者に対して遺伝学的検査(確定診断)を行う、という診断の流れが推奨されています2)。その方法として、①三段階のステップ(第1次スクリーニング、第2次スクリーニング、遺伝学的検査(確定診断))で行う方法と、②二段階のステップ(ユニバーサルスクリーニング、遺伝学的検査(確定診断))で行う2通りの方法があります(図1)。
- ※遺伝性大腸癌診療ガイドライン2020年版
図21より改変
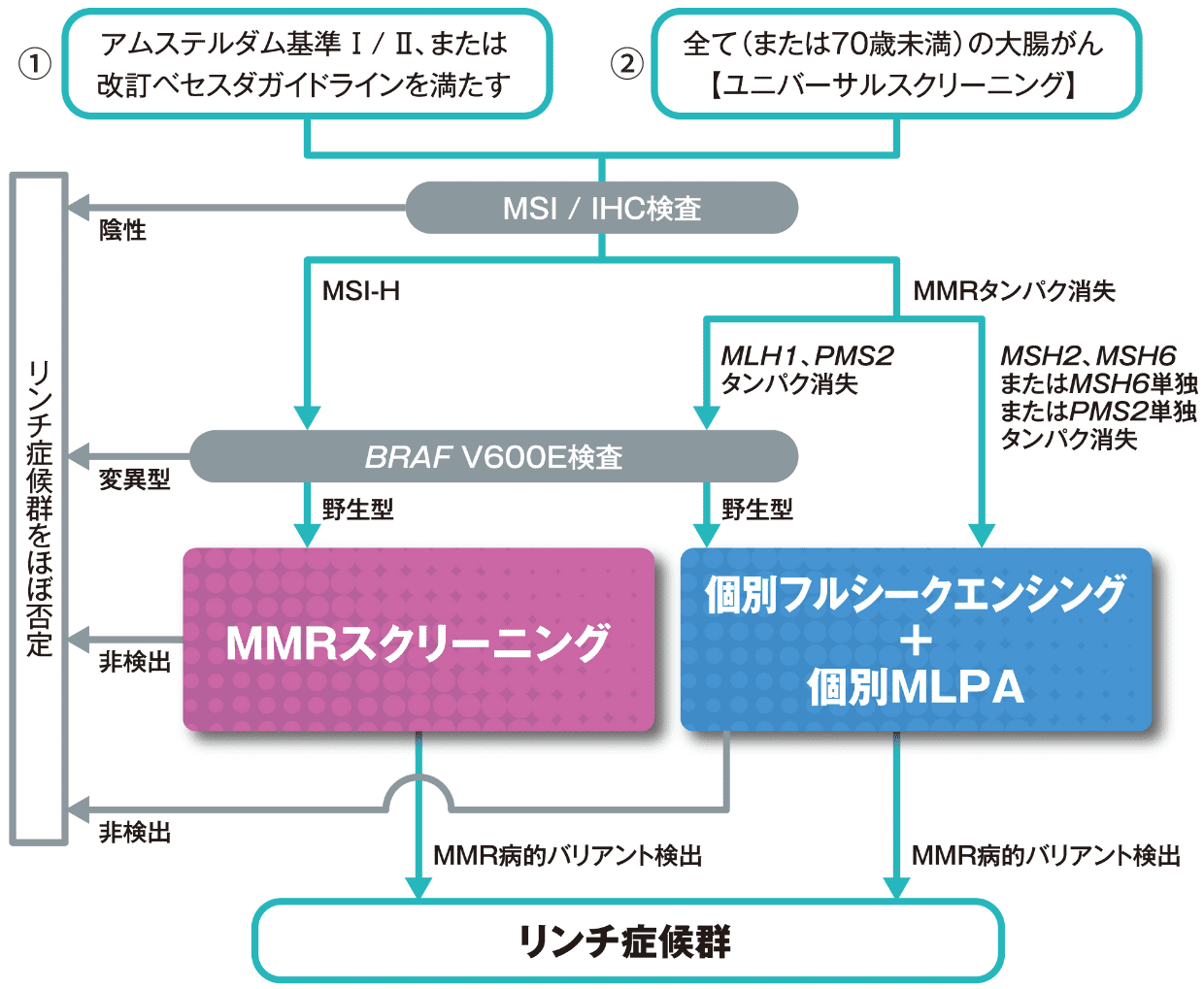
図1 LSの検査/診断フロー(大腸がん)
①の方法では、患者の家族歴などを含む臨床情報からLSが疑われる患者に対し、まず、アムステルダム基準Ⅱあるいは改訂ベセスダ基準を満たすかを確認し(第1次スクリーニング)、次にMSI検査または免疫組織学的検査(IHC検査)を行います(第2次スクリーニング)。
第2次スクリーニングで異常が認められた場合には、遺伝カウンセリング受診が推奨されます。遺伝カウンセリングでは、治療やサーベイランスも含めたLSについての詳しい説明、遺伝形式・遺伝学的検査に関する説明だけでなく、患者の置かれている背景や考え、悩みなど様々なことを考慮した話し合いが行なわれます。そして、患者が希望した場合に、4種類のミスマッチ修復(MMR)遺伝子とその中のMSH2遺伝子と関係の深いEPCAM遺伝子の5種類の遺伝子について、生殖細胞系列での遺伝学的検査を実施します。その遺伝学的検査でいずれかの遺伝子に病的バリアントが検出されると、LSと確定診断されます。
一方、②の方法では患者の臨床情報に関係なく、全て(または70歳未満)の大腸がん・子宮内膜がんに対しMSI検査またはIHC検査を行い(ユニバーサルスクリーニング)、異常が認められた場合に①と同様、遺伝カウンセリング受診を推奨します。そして、患者が希望した場合にMMR遺伝子とEPCAM遺伝子の生殖細胞系列の遺伝学的検査を実施します。
参考1)アムステルダム基準
1990年に国際的な研究グループであるICG-HNPCC(the International Collaborative Group on Hereditary Non-polyposis Colorectal Cancer)が研究目的として「アムステルダム基準」を発表しました4)。その後、大腸がんだけではなく、その他の関連がんを含めた評価基準「アムステルダム基準Ⅱ」を発表しました(1998年)5)。
複数の研究をまとめた報告では、MMR遺伝子に病的バリアントが見つかった症例のうちアムステルダム基準IIを満たしていたのは41%であったとされています6)。
【アムステルダム基準Ⅱ】
少なくとも3人の血縁者がHNPCC(LS)関連腫瘍(大腸がん、子宮内膜がん、腎盂・尿管がん、小腸がん)に罹患しており、以下のすべてを満たしている。
- 1.1人の罹患者はその他の2人に 対して第1度近親者である。
- 2.少なくとも連続する2世代で罹患している。
- 3.少なくとも1人のがんは50歳未満で診断されている。
- 4.腫瘍は病理学的にがんであることが確認されている。
- 5.家族性大腸腺腫症(FAP)が除外されている。
参考2)ベセスダ基準
LSの大腸がんの病変組織において、MSI-Highという特徴が見られることが分かっています。そこで、LSの補助診断としてMSI検査を適用する対象基準(ベセスダ基準:1998年、改訂ベセスダ基準:2004年)が、NCI(National Cancer Institute)より提唱されました7)。
【改訂ベセスダ基準】
以下の項目のいずれかを満たす大腸がん患者には、腫瘍のMSI検査が推奨される。
- 1.50歳未満で診断された大腸がん。
- 2.年齢に関わりなく、同時性あるいは異時性大腸がんあるいはその他のLS関連腫瘍*がある。
- 3.60歳未満で診断されたMSI-Hの組織学的所見**を有する大腸がん。
- 4.第1度近親者が1人以上LS関連腫瘍に罹患しており、そのうち一つは50歳未満で診断された大腸がん。
- 5.年齢に関わりなく、第1度あるいは第2度近親者の2人以上がLS関連腫瘍と診断されている患者の大腸がん。
*:大腸がん、子宮内膜がん、胃がん、卵巣がん、膵がん、胆道がん、小腸がん、腎盂・尿管がん、脳腫瘍(通常はターコット症候群にみられるglioblastoma)、ムア・トレ症候群の皮脂腫瘍や角化棘細胞腫
**:腫瘍内リンパ球浸潤、クローン様リンパ球反応、粘液がん・印環細胞がん様分化、髄様増殖
参考3)ユニバーサル・スクリーニング
近年、LSを疑う所見の有無にかかわらず、全て(または70歳以下)の大腸がん・子宮内膜がんに対し、MSI検査やIHC検査を行うことが提唱されています2)。
海外の報告では、ユニバーサルスクリーニングで得られたLSの頻度は2.4~3.7%とされています8)9)。
欧米では、70歳未満のLSの診断に関しては、感度と費用対効果の高い方法としてユニバーサルスクリーニングが推奨されています1)。一方、高齢の大腸がん患者はLSよりも、散発性ミスマッチ修復異常大腸がんの頻度が高い傾向があるともいわれています10)11)12)。そのため対象患者の年齢を考慮してスクリーニングを行うことも提唱されています2)。
参考4)IHC検査
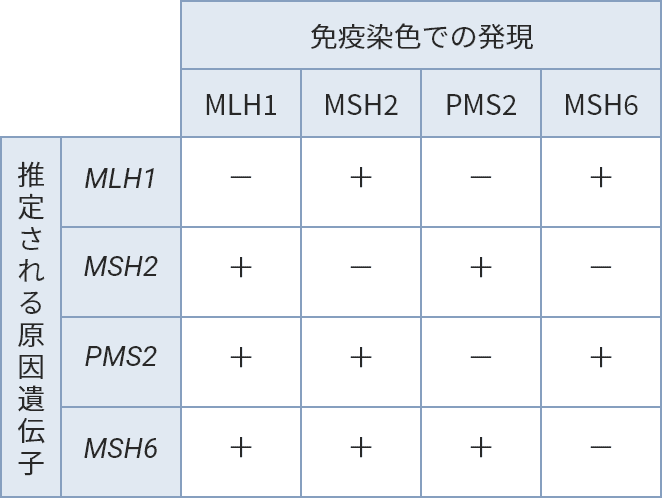
ミスマッチ修復異常のある腫瘍では、異常のあるミスマッチ修復遺伝子と関連したタンパクの発現消失を示します。IHC検査のタンパクの発現消失パターンから、どのミスマッチ修復遺伝子に異常があるかを推測できます。
IHC検査のミスマッチ修復タンパクの染色パターンから推定される原因遺伝子2)
遺伝学的検査
MMR遺伝子に同定される病的バリアントは、塩基配列解析(DNAシークエンシング)による検出が可能な塩基置換や数塩基程度の欠失の他に、欠失/重複解析(MLPA法)でしか検出できないエクソン単位の大欠失がMLH1遺伝子で10~20%、MSH2遺伝子で20~40%、MSH6遺伝子で0~10%、PMS2遺伝子で20~55%を占めるとの報告があります13)。
また、EPCAM遺伝子の場合は、3’側の大欠失のみであるため欠失/重複解析(MLPA法)が用いられます。
遺伝学的検査を行う意義
MMR/EPCAM遺伝子の病的バリアントの検出によりLSと確定診断することは、LSの臨床的特徴に応じた医学的管理を行う根拠となります。例えば、LSの大腸がんの術後には、残存大腸に異時性の大腸がんが発生することを考慮して、生涯にわたり定期的に大腸内視鏡検査を受けることが推奨されています。
また、LSと診断された方やそのリスクがある方に対しては、LS関連がんの発症リスクが高いことを考慮して、子宮や卵巣などについても定期的な検診(サーベイランス)を行うことが推奨されています。さらに、LSと診断された方(発端者)の血縁者においては、発端者で見つかった病的バリアントの有無のみを確認するシングルサイト検査を行うことができます。発端者と同じ病的バリアントが検出された場合、未発症の時期から効果的なサーベイランスを実施することで早期診断や早期治療が可能になります。また、病的バリアントを持たない血縁者では、必ずしも必要のない過剰なサーベイランスの実施を回避することができます。
がん未発症の場合でも病的バリアントを持つ方に対しては、一般のがん検診ではなくLSに合わせたサーベイランスを行うことが推奨されています。
サーベイランスの内容は国・グループによって異なる部分もありますが、遺伝性大腸癌診療ガイドラインには次の表が記載されています(表2)。
表2 推奨されているサーベイランス2)
| 部位 | 検査方法 | 検査開始年齢 | 検査間隔 |
|---|---|---|---|
| 大腸 | 大腸内視鏡 | 20~25歳 | 1~2年 |
| 子宮・卵巣 | 経腟超音波・子宮内膜組織診・ 子宮内膜細胞診・CA125 |
30~35歳 | 1年 |
| 胃・十二指腸 | ヘリコバクター・ピロリ感染 (感染があれば除菌) |
30~35歳 | ─ |
| 上部消化管内視鏡※1 | 30~35歳 | 1~3年 | |
| 尿路 | 検尿・尿細胞診※2 | 30~35歳 | 1年 |
| 大腸 | 検査方法 大腸内視鏡 |
検査開始年齢 20~25歳 |
検査間隔 1~2年 |
|||
|---|---|---|---|---|---|---|
| 子宮・卵巣 | 検査方法 経腟超音波・子宮内膜組織診・ 子宮内膜細胞診・CA125 |
検査開始年齢 30~35歳 |
検査間隔 1年 |
|||
| 胃・十二指腸 | 検査方法 ヘリコバクター・ピロリ感染 (感染があれば除菌) |
検査開始年齢 30~35歳 |
検査間隔 ─ |
検査方法 上部消化管内視鏡※1 |
検査開始年齢 30~35歳 |
検査間隔 1~3年 |
| 尿路 | 検査方法 検尿・尿細胞診※2 |
検査開始年齢 30~35歳 |
検査間隔 1年 |
- ※1:胃がんリスクの高い集団(東アジアなど)、または胃・十二指腸がんの家族歴がある場合に考慮
- ※2:MSH2の病的バリアント、または尿路上皮がんの家族歴がある場合に考慮
LSの原因遺伝子のうち、どの遺伝子に病的バリアントがあるかによって各がんの発症リスクは異なります。そのため、NCCNガイドラインでは原因遺伝子ごとに異なったLS関連がんのサーベイランスを行うことが推奨されています1)。しかし、日本人では原因遺伝子別のLS関連がん発症リスクについては十分に調べられていないのが現状です。
遺伝形式と浸透率
LSは、常染色体顕性遺伝(優性遺伝)形式をとります。よって、原因遺伝子に病的バリアントが検出された場合、その方の子どもには性別にかかわらずそれぞれ1/2(50%)の確率で同じ病的バリアントが受け継がれます。
ただし、原因遺伝子の病的バリアントがあると必ずがんにかかるというわけではありません。病的バリアントを持っていても、生涯LS関連がんを発症しない(不完全浸透)方が15~20%いるとの報告があります14)。そのため、親や兄弟姉妹、その他の血縁者の病的バリアントの保有の可能性を検討する場合は、不完全浸透による未発症の状態も考慮することが必要です。
受託要件
当社にて遺伝学的検査を受託するにあたっては、【受託実施指針】に従い、「体制確認書」の提出をお願いしています。
ご依頼いただく際は、お問い合わせください。
検査項目
| 検査項目 | 検体量 (末梢血) |
保存条件 | 検査日数 | 検査方法 | |||
|---|---|---|---|---|---|---|---|
| 全血2ml | 冷蔵 | 21~22日 | |||||
| MMRスクリーニング | MLH1、MSH2、MSH6、PMS2遺伝子の全翻訳領域のエクソン19個(エクソン1~19)、16個(エクソン1~16)、10個(エクソン1~10)、15個(エクソン1~15)と隣接するイントロン領域について塩基配列を解析します。あわせてMLH1、MSH2、MSH6、PMS2、EPCAM遺伝子エクソンレベルの比較的大きな欠失や重複も同時に解析します。 | 全血2ml | 冷蔵 | 21~22日 | NGS法およびMLPA法 | ||
| MLH1フルシークエンシング | MLH1遺伝子の全翻訳領域の19個のエクソン(エクソン1~19)と隣接するイントロン領域について塩基配列を解析します。 | 全血2ml | 冷蔵 | 21~22日 | NGS法 | ||
| MSH2フルシークエンシング | MSH2遺伝子の全翻訳領域の16個のエクソン(エクソン1~16)と隣接するイントロン領域について塩基配列を解析します。 | 全血2ml | 冷蔵 | 21~22日 | NGS法 | ||
| MSH6フルシークエンシング | MSH6遺伝子の全翻訳領域の10個のエクソン(エクソン1~10)と隣接するイントロン領域について塩基配列を解析します。 | 全血2ml | 冷蔵 | 21~22日 | NGS法 | ||
| PMS2フルシークエンシング | PMS2遺伝子の全翻訳領域の15個のエクソン(エクソン1~15)と隣接するイントロン領域について塩基配列を解析します。 | 全血2ml | 冷蔵 | 21~22日 | NGS法 | ||
| MMR MLPA | MLH1、MSH2、MSH6、PMS2、EPCAM遺伝子のエクソンレベルの比較的大きな欠失や重複を解析します。 | 全血2ml | 冷蔵 | 21~22日 | MLPA法 | ||
| MLH1/MSH2 MLPA | MLH1、MSH2、EPCAM遺伝子のエクソンレベルの比較的大きな欠失や重複を解析します。 | 全血2ml | 冷蔵 | 21~22日 | MLPA法 | ||
| 追加MLH1/MSH2 MLPA | 当社にてMLH1・MSH2・MSH6・PMS2フルシークエンシングを実施し、追加にてMLH1/MSH2遺伝子のMLPAを解析する場合はこちらをオーダーください。 | 全血2ml | 冷蔵 | 21~22日 | MLPA法 | ||
| MSH6/PMS2 MLPA | MSH6、PMS2遺伝子のエクソンレベルの比較的大きな欠失や重複を解析します。 | 全血2ml | 冷蔵 | 21~22日 | MLPA法 | ||
| 追加MSH6/PMS2 MLPA | 当社にてMLH1・MSH2・MSH6・PMS2フルシークエンシングを実施し、追加にてMSH6/PMS2遺伝子のMLPAを解析する場合はこちらをオーダーください。 | 全血2ml | 冷蔵 | 21~22日 | MLPA法 | ||
| シングルサイト | シングルサイトにつきましては、こちらをご確認ください | ||||||
- 【ご注意ください】
-
- 1)造血器腫瘍を発生したことのある被検者は、検査が出来ない場合があります。別途ご相談下さい。
- 2)EDTA 2Naによる採血を推奨しています。
- 3)所要日数は、検体を受領した翌日を起算日として、祝日を除いた日数です。
- 4)遺伝子の5’UTRや3’UTRおよびイントロンの深部(エクソンとの境界部から離れた領域)は解析の対象外です。
参考文献
- 1)NCCN Guidelines® Genetic/Familial High-Risk Assessment:Colorectal Version 1.2022
https://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf - 2)遺伝性大腸癌診療ガイドライン2020年版
- 3)がん情報サービス 累積がん罹患リスク(2018年データ)
https://ganjoho.jp/reg_stat/statistics/stat/summary.html - 4)Vasen HF, et al. Diseases of the colon and rectum: Vol.34: p424-425, 1991
- 5)Vasen HF, et al. Gastroenterology: Vol.116: p1453-1456, 1999
- 6)Vasen HF, et al. Journal of Medical Genetics: Vol.44: p353-362, 2007
- 7)Umar A, et al. Journal of the National Cancer Institute: Vol.96(4): p261-268, 2004
- 8)Canard G,et al.Ann Surg Oncol 2012;19:809-816
- 9)Julie C,et al.Am J Gastroenterol 2008;103:2825-2833;quiz 2836
- 10)Chika N, et al. Jpn J Clin Oncol 2017;47:108-117
- 11)Moreira L,et al.JAMA 2012;308:1555-1565
- 12)Jiang W,et al.Int J Cancer 2019;144:2161-2168
- 13)GeneReviewsJapan
http://grj.umin.jp/grj/lynch.htm - 14)Onka B et al.BJR Case Rep. 2022 Jan 12;8(2):20210230.
